薬用キノコがどのようにがんと闘うのか: メカニズムの紹介
仕組みの概要
の活動 キノコ由来の薬効成分 非常に複雑かつ多様です。最も重要な薬用キノコのメカニズムは、 宿主媒介免疫応答 (免疫調節) および 細胞毒性/細胞増殖抑制効果.
どちらも発がんの 8 つの主要な段階を阻害します。
- 慢性炎症(がんにつながる突然変異や適応を誘発する可能性がある)
- がん細胞の増殖(制御されない細胞分裂と増殖)
- 接着(細胞同士や健康な細胞に接着する能力)
- アポトーシス(がん細胞はプログラムされた細胞死の能力を失った)
- 血管新生(腫瘍に栄養を与える新しい血管の構築)
- 遺伝子発現(遺伝子からの情報を使用して、タンパク質や機能的RNAなどの遺伝子産物を合成する)
- 浸潤性(がん細胞が健康な組織に侵入し、拡散する)
- 転移(離れた臓器への広がり)。
宿主の免疫系を媒介することは、一般に「免疫系のブースト」と呼ばれ、自然免疫と後天性の両方の一般的およびがん特異的な宿主媒介免疫反応を刺激および調節するさまざまな方法を指します。特に、真菌のベータグルカンはこれらのメカニズムに影響を与えます。
細胞毒性、または癌細胞に対する毒性は、壊死またはアポトーシス (プログラムされた細胞死) による癌細胞死につながる直接的な影響です。これには、制癌性の修飾 (増殖の減速、または制御されない癌細胞の分裂)、分化した良性細胞へのより迅速な成熟、および免疫系が容易に認識できるように癌細胞を修飾することが含まれます。
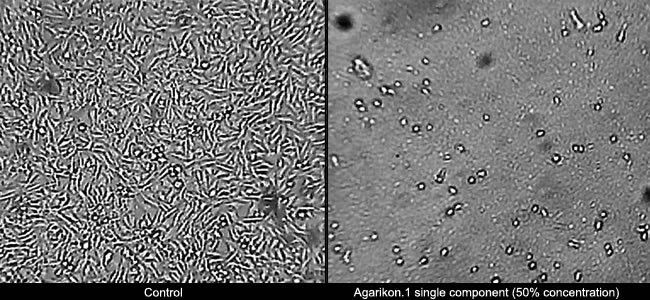
左側がコントロールです。右側は、50% 濃度の単一 Agarikon.1 成分で、直接的な細胞毒性効果 (癌細胞を殺す) を示しています。
出典: ルドジャー・ボスコビッチ研究所
宿主媒介免疫応答の変化
一部の薬用キノコ化合物 (特に一部のベータグルカン) は、宿主媒介の癌免疫応答を改善します。ユーザーがベータグルカンを摂取すると、腸壁のパイエル板が刺激されます。パイエル板は、マクロファージ、樹状細胞、B リンパ球および T リンパ球による免疫応答の生成を助けます。体は免疫システムを高めることで適応します。

シイタケ由来の化合物であり、日本で正式に抗がん剤として使用されているレンチナンは、ほとんどのベータグルカンがどのように作用するかを示す好例です。レンチナンはがん細胞に対して毒性はありませんが、免疫系を調節するため、がん細胞に対してより攻撃的かつ効果的になります。レンチナンは以下の生産を改善します。
- 免疫強化物質:
- 抗体
- サイトカイン (インターフェロンおよびインターロイキン、特に IL-1)
そして、以下の活動を強化します。
- ナチュラルキラー細胞(NK細胞)
- 細胞傷害性マクロファージ
- 細胞傷害性Tリンパ球とヘルパーTリンパ球
- 古典的補体経路と代替補体経路
免疫力を弱める物質(免疫抑制剤)の生成を抑制します。
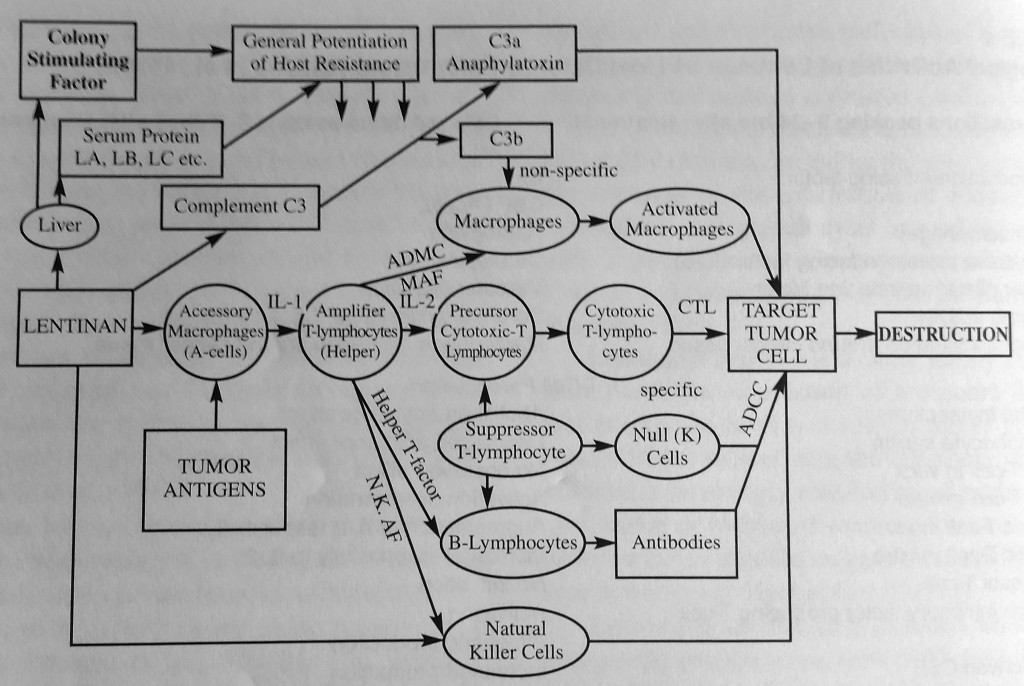
ご覧のとおり、レンチナンの活動はよく知られていますが、非常に複雑でもあります。レンチナンは、がんの進行に重要なさまざまな経路を遮断します。
レンチナンは免疫システムを強化し、癌やウイルス感染と戦うことが証明されています。
薬用キノコに含まれる他のベータグルカン (SPG、PSK など) も同様に作用しますが、同じではありません。主にいくつか
- 先天性および獲得免疫反応を刺激する
- 免疫担当細胞の産生を増強する
- 機能的能力を向上させる
- がん細胞を認識して殺すのを助ける
- 免疫力の低下などから守ります。
細胞傷害性および制がん性活性
沢山あります 薬用キノコ化合物 (特定の多糖類、タンパク質結合多糖類、リグニン、トリテルペン、プリン、ポリフェノールなど) これらは免疫システムを変更するだけではありません。それらの中には、がん細胞に対して毒性を示すもの(細胞毒性)もあれば、がん細胞の機能を微妙に変化させるものもあります。
多くの薬用キノコ化合物は直接的な細胞毒性活性を示します。それらは壊死を誘導し、アポトーシスを促進することによって癌細胞死を引き起こす可能性があります。壊死は細胞死につながる細胞損傷です。化合物はがん細胞膜とミトコンドリア(細胞の「発電所」)に損傷を与えます。アポトーシスはプログラムされた細胞死です。化合物は細胞死につながる生化学的現象を引き起こします(がん細胞の特性の 1 つは、アポトーシスがこの能力を失い、増殖または制御されない細胞分裂を可能にすることです)。
しかし、がん細胞の機能に悪影響を与えるさらに潜行的なプロセスが存在します。それらは、がん細胞の発生を阻害したり、がん細胞の成熟を加速したり(がん細胞を良性の分化した細胞に変える)、がん細胞を検出しやすくしたり、免疫系に対して脆弱にしたりするなどです。
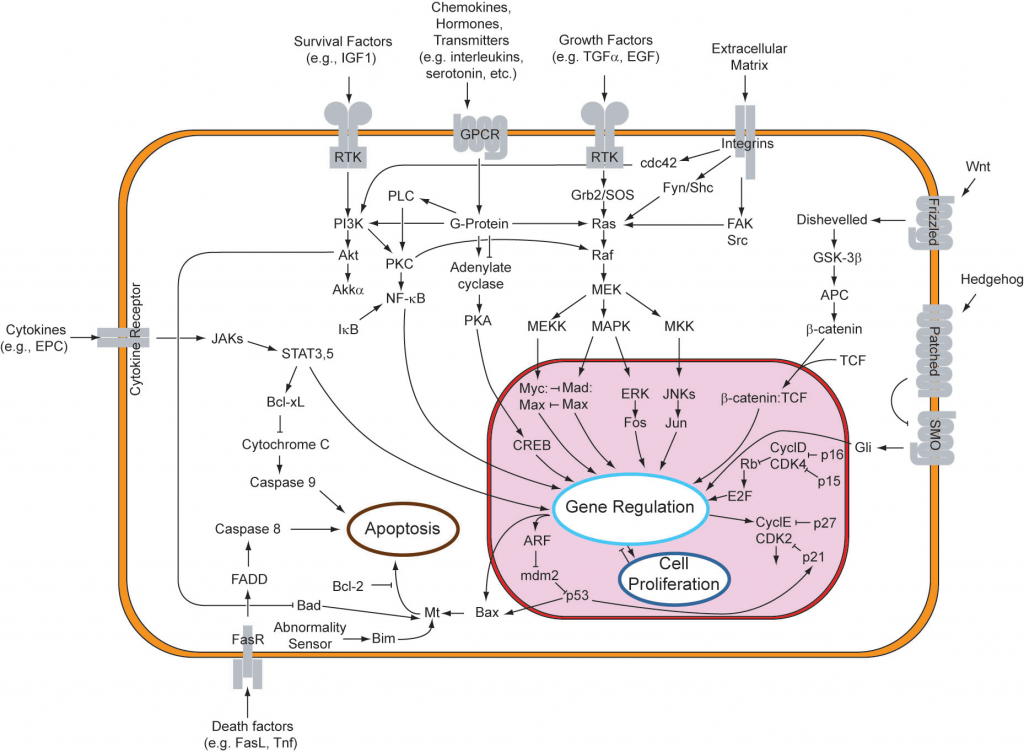
そして、そのメカニズムについては多くのことがわかっていますが、未解決の問題もまだたくさんあります。
メカニズムの研究は続けられていますが、薬用キノコ化合物が癌患者を助けることができることはすでに疑いの余地なくわかっています。
- 全体的な転帰を改善する(生存の可能性と寿命の延長を含む)
- 進行性の腫瘍疾患を安定した疾患に切り替えるのに役立ちます
- 原発腫瘍および転移におけるがんのサイズを縮小する
- 副作用が少なく、化学療法や放射線療法に耐えられる
- 創傷治癒の改善などにより、手術への耐性が向上し、術後の回復が促進されます。
- 正式ながん治療による免疫システムの低下を防ぐ
- 生活の質が大幅に向上します(体力と持久力が向上し、睡眠と食欲が向上し、痛み、吐き気、疲労が軽減されます)。
メカニズムの研究により、これらの効果が説明されます。これらの効果は、逆説的に言えば、最初に観察されたものです。 人間の臨床試験 –そして次の記事でも報告されています コホート研究 ミコサンが完成させたもの。
